双空间平台强强联用系列文章之二研究人员如何及何时使用和
我们最近讨论了Visium空间基因表达平台和Xenium原位空间转录组学平台的主要特点,包括多重性、灵敏度和分辨率等技术方面的考量(请参考往期文章:【突破空间组学研究极限】VisiumHD与XeniumInSitu的完美融合)。您可以根据这些信息来考虑哪个平台最适合您当前的应用,或者是否应该同时使用这两个平台。
正如“一图胜千言”,其他人如何做出这一决策的真实案例也很有帮助。那么,其他科学家如何利用这些空间转录组学工具来解决他们的生物学问题呢?Visium和Xenium的哪些优势助力每项研究获得更多见解?其他科学家如何利用一种技术的见解为另一种技术的实验提供信息?
在本系列文章的第一篇,我们介绍了利用两种平台绘制人类肺癌早期阶段的肿瘤-免疫组成,以及确定小鼠丘脑的细胞-分子结构两项研究。本文将重点介绍另外两项研究。这些文献使用Visium和Xenium来研究同一种生物系统,但研究的角度和目标却各不相同。
主要内容
追踪腭裂的发育
Visium分析建立了参与小鼠正常腭部融合的细胞类型和基因的基线图谱,并鉴定出三个以前未报道过的参与纤毛功能的基因。
将Xenium与Chromium单细胞多组学ATAC 基因表达分析结合使用,从功能上表征Pax9(一种已知的参与颅面发育的转录因子)与Wnt信号通路之间的关系,在腭裂小鼠模型上找到受Pax9缺失影响的特定细胞类型,确定疾病的可能机制。
在异质性FFPE乳腺癌样本中发现三阳性区域
Xenium分析鉴定出一小块病理学注释遗漏的三阳性区域,并确定了同一张乳腺癌组织切片上浸润性肿瘤和导管原位癌(DCIS)区域的细胞组成和各自独有的基因标志物。
利用Visium全基因组数据来表征这个特定三阳性肿瘤区域与其他肿瘤区域的差异表达基因,并定义异质性DCIS亚型所特有的基因表达特征和基因本体。
生物体的发育简直是个奇迹:单个细胞分裂、分化,最终形成复杂的多细胞生物。考虑到发育的复杂性,在发育过程中难免会出现一些失误。腭裂就是这样一种与环境和遗传都有关的常见疾病,它指的是口腔顶部不能完全闭合。
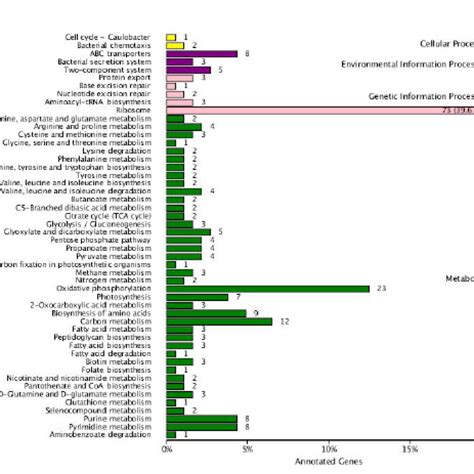
为了更好地了解这种疾病,美国NIH下属EuniceKennedyShriver国家儿童健康与人类发育研究所(NICHD)的D’Souza研究团队试图利用胚胎小鼠模型来绘制驱动正常腭部融合的活性基因图谱(1)。他们对采集自两个过渡阶段(腭架接触(E14.5)和腭部融合(E15.5))的福尔马林固定石蜡包埋(FFPE)的鄂中部冠状切片开展了Visium分析,建立了两个组织阶段之间差异表达基因的空间分辨图谱(图1)。
他们的全转录组Visium实验揭示了三个之前未报道过的腭部融合相关基因——Deup1、Dynlrb2和Lrrc23,它们都参与了纤毛功能,双空间平台强强联用系列文章之二研究人员如何及何时使用和在E15.5阶段定位于腭部带纤毛的鼻上皮中。这些发现表明,鼻上皮细胞可能在腭架融合过程中发挥了促进细胞迁移的特殊作用。
图1
将整个胚胎头部的鄂中部冠状切片放置在带有条形码的Visium玻片上。
(A)根据整个胚胎头部定义体内细胞簇,展示表达的空间关系和形态发生多样性,进一步筛选出仅编码每张切片腭部组织内的条形码的细胞簇,以鉴定腭部E14.5和E15.5阶段的最大差异表达基因(B)。
(C)三个鉴定出的富集基因的空间表达特征图。
(D)彩色圆圈对应了直径55μm的Visiumv2转录组分析分辨率。
LoupeBrowser描绘出的表达水平增加在图中以颜色较深的绿色(Deup1)、蓝色(Dynlrb2)或红色(Lrrc23)表示。
这些基因的组合定位以重叠的彩色同心圆圈表示,其直径与表达程度无关。
图片改编自Piñaetal.2023中的图5。(CCBY4.0).
在建立了正常腭部融合的细胞和分子基线图谱后,研究团队开展了后续分析,以理清Pax9-/-转基因小鼠腭裂模型的分子基础(2)。他们知道Pax9基因编码的转录因子会影响Wnt信号通路,这是胚胎发育的主要调节因子,但不清楚Pax9与Wnt信号通路之间的确切关系。
研究团队首先利用单细胞多组学ATAC 基因表达(多组学)技术,同时分析了野生型(WT)和Pax9-/-小鼠在腭部发育过程中的基因表达和开放染色质区域。他们鉴定出多个转录上不同的细胞簇,其中包括WT小鼠的一个大的间充质细胞簇。在进一步分析这些细胞类型后,他们发现间充质细胞中的一个独特亚簇不仅表现出Pax9RNA的大量富集(>3.5倍),还富集包含Pax9结合基序的开放染色质。值得注意的是,他们还观察到Pax9的表达并不是成骨细胞所必需的。
当他们用Pax9-/-小鼠重复这些实验时,研究人员发现了两处明显的差异。首先是成骨细胞的比例增加了,这表明腭部骨化发生了改变。其次,两个Wnt信号调节因子Dkk1和Dkk2的染色质可及性明显增加,这与Pax9缺乏引起的Wnt信号动态改变一致。

为了探究成骨分化是否需要Pax9对Wnt信号通路的调节,研究人员转向Xenium原位分析,使用了含350个基因的定制基因组合来分析细胞类型、效应物-配体和独特的标志物。利用Xenium分析,他们能够对WT和Pax9-/-小鼠的整个头部FFPE组织冠状切片进行单细胞空间成像(图2)。
基于Xenium数据的细胞聚类分析发现WT和Pax9-/-小鼠有28个不同的细胞簇。利用该技术提供的空间分辨率,研究人员重点对位于腭部的细胞簇进行基因表达分析,以揭示Pax9缺失带来的差异。研究发现了两组小鼠之间独有和重叠的间充质细胞和上皮细胞簇。值得注意的是,有一个上皮细胞簇虽然在两组小鼠中都存在,但其中两个Wnt基因(Wnt5a和Wnt7b)在WT小鼠普遍表达,而在Pax9-/-小鼠中的表达量却低得多。
再回到多组学分析中发现的Wnt调节因子Dkk1和Dkk2,研究人员不仅观察到这些基因在Pax9-/-腭裂中明显增加,还观察到它们独特的空间模式(图2)。他们特别感兴趣的一点是,Dkk2在中线边界处表达,而与Wnt重叠通路相关的其他几个基因(Bmp2、Bmp4、Fgfr1和Gli1)在这一区域缺乏表达。
综上来说,这些结果符合以下观点:1)Pax9的表达在腭部间充质细胞的定型和细胞命运中发挥功能性作用;2)Pax9的缺失会诱导中线Dkk2的表达,而后者会抑制Wnt诱导的骨生成;3)这些过程可能是腭裂形成的机制之一。
图2
利用Xenium从转录组和形态上表征WT和Pax9-/-小鼠的腭部。
(A)胚胎WT和Pax9-/-小鼠的整个头部冠状切片,图中显示基于Xenium的细胞簇(第二行)和Xenium后的H&E染色结果(第一行)。
Wnt调节因子Dkk1和Dkk2(第三行)以及Sp7(额骨边界标志物)的空间位置显示出不同的表达模式。
图片改编自Piñaetal.2023中的图3和图4。(CCBY4.0).
解析乳腺导管原位癌的异质性
试图了解癌症如何从原位癌转化为浸润性癌症,这并不是一个新问题——但对所有癌症来说是一个关键问题,包括乳腺癌。乳腺导管原位癌(DCIS)被认为是乳腺癌的最早期阶段,因此解析肿瘤微环境中的细胞和分子异质性至关重要,包括表征新兴的肿瘤亚型,因为这些特征促进了疾病进展,并为治疗决策提供了信息。
10xGenomics的科学家团队利用我们的三个技术平台对人类FFPEDCIS组织块的肿瘤微环境进行深入表征,包括Chromium基因表达Flex、VisiumCytAssist和Xenium原位分析平台(3)。他们首先采用了基于发现的全转录组方法,对相邻组织切片进行单细胞(scFFPE-seq)和Visium空间分析,绘制出肿瘤样本细胞组成和空间结构的综合图谱。这种综合方法定位了肿瘤切片内的细胞类型和疾病状态,包括对三个肿瘤区域以及其他免疫细胞、基质细胞和脂肪细胞进行空间定位(图3),这三个肿瘤区域包括两个分子上不同的DCIS类型(DCIS#1和#2)和一个浸润性肿瘤区域。
图3
利用全转录组单细胞和空间技术对FFPE保存的乳腺癌样本进行表征。
(a)对scFFPE-seq数据进行降维处理后,产生了带有17个无监督聚类的t-SNE投影。
(b)对Visium数据点的t-SNE投影也鉴定出17个聚类。根据差异基因表达分析,10个聚类可明确分配到细胞类型,而其他聚类则是细胞类型的混合物。
(c)图中显示了CytAssist前进行的H&E染色结果以及(b)中聚类的空间分布。细胞类型特异性的标志物基因以log2(归一化UMI计数)表示。
Visium数据阐明了两种分子上不同的DCIS及浸润性亚型的空间位置,以及免疫细胞、肌上皮细胞、脂肪细胞和基质细胞的大概位置。
此外,Visium还特有线粒体探针(如MT-ND1),其空间分布与组织切片的浸润性区域相关。
本实验在两张连续切片上进行,图中显示的是其中一张代表性切片。
图片改编自Janesicketal.2023中的图2。(CCBY4.0).
为了进一步表征和完善肿瘤微环境内小的细胞邻域的关系,10x研究团队转向了Xenium分析,使用了包含313个基因的人类乳腺基因组合,它具有亚细胞空间分辨率。根据H&E染色后的传统组织病理学评估,肿瘤切片被注释为HER2 /ER /PR-,这意味着样本表达人类表皮生长因子受体2(HER2/ERBB2)和雌激素受体(ER/ESR1),但不表达孕酮受体(PR/PGR)。不过值得注意的是,Xenium空间分析显示,肿瘤内有一小块区域呈现ERBB2、ESR1和PGR转录本的三阳性表达(HER2 /ER /PR )。这意味着异质性样本中存在另一种癌症亚型,可能对分类和治疗很重要。此外,通过整合的单细胞数据,Xenium还有助于确定细胞组成和独有的表达标志物,以便区分浸润性和DCIS区域。例如,研究团队观察到,与DCIS#1相比,DCIS#2中浸润性肿瘤细胞的比例增加,表明这个亚型的侵袭性更强。他们还能通过Xenium清晰定义DCIS#2肿瘤边界,其中一层薄薄的肌上皮细胞包裹着浸润性细胞。
Visium全转录组分析对于进一步表征Xenium发现的三阳性小区域也很重要(图4)。利用Xenium数据对Visium数据进行解卷积,研究团队开展了数据点插值,显示了覆盖三阳性区域的Visium数据点内的细胞类型比例,并对这些数据点与其他所有恶性数据点进行差异基因表达分析。他们发现,与DCIS#1相比,PGR 数据点中有48个差异表达基因,与DCIS#2相比有44个差异表达基因。基因本体分析从基因功能上进一步区分了这些肿瘤区域:PGR 区域的表达特征与雌激素受体信号通路有关,DCIS#1主要显示了代谢的特征,而DCIS#2的基因与干扰素信号通路有关。
图4
Visium和Xenium整合分析推断出三阳性受体ROI中的差异表达基因。
(a)ERBB2(HER2-灰色)、ESR1(雌激素受体-绿色)和PGR(孕酮受体-洋红色)编码转录本的Xenium空间图。
(b)三阳性ROI的近景图。
(c)对应的H&E图像。
(d)ROI包含的细胞类型显示这是DCIS#2的肿瘤上皮。(e)(b)的单张Xenium空间图。
(f)ChromiumscFFPE-seq只获得了约30个PGR阳性的细胞,但这些细胞不表达ERBB2或ESR1。
(g)Visium分析鉴定出三阳性区域(根据Xenium的先验知识),并且是独特聚类中的一部分(h)。
(i)数据点插值提供了每个Visium数据点内的细胞类型频率。
(j)VisiumH&E图像以及Visium数据揭示的肿瘤上皮内四个有代表性的差异表达基因。
图片改编自Janesicketal.2023中的图5。(CCBY4.0).
这项研究证明了一个重要规律:“简单的”DCIS样本可能根本不简单。相反,它的异质性非常高,包含多个肿瘤亚型,这不仅影响癌症分类,还可能影响疾病进展和治疗反应。全转录组单细胞和空间方法的整合分析,再加上最高单细胞分辨率的靶向分析,可以阐明这种异质性,并确定向浸润性癌症发展所涉及的细胞状态和生物标志物。
若想深入了解这项研究,欢迎点击查看更多往期文章:
【微信文章】10x作者讨论将单细胞和空间平台的见解相结合有何价值
【微信文章】一项对Xenium推动的研究成果的重点解析
利用多层面工具包提升空间生物学研究的水平
正如这些研究所展示的,使用多种空间生物学工具可以帮助您更清晰地了解某个组织的真实生物学特征。与单独使用一种技术相比,Visium全转录组空间发现和Xenium精确单细胞空间成像的组合可揭示更高的异质性,但并非总是必要。此外,传统的单细胞分析与这些空间技术中的一种或两种结合使用都有很高的价值,能够提供完整细胞的分辨率,并将这些信息嵌入组织结构的轮廓中。
本系列文章提供的范例并没有尽数列出Visium和Xenium的单独或组合应用。我们期待,作为我们的创新客户和科研伙伴,您将设想出上述应用之外的其他应用——我们对您的研究拭目以待。
作者注:
本系列文章中介绍的研究使用了我们的Visium空间基因表达v2分析。我们最近推出了VisiumHD,这种全转录组空间分析带来了单细胞尺度的分辨率。无论如何,这些研究为全转录组发现方法与Xenium原位靶向分析的互补应用指明了方向。若想了解VisiumHD早期用户的应用,请查看VisiumHD介绍文章以及我们对AACR2024年会的回顾。
VisiumHDiscoming!
参考资源:
1.PiñaJ,etal.Multimodalspatiotemporaltranscriptomicresolutionofembryonicpalateosteogenesis.NatCommun14:5687(2023).doi:10.1038/s41467-023-41349-9
2.PiñaJ,etal.SpatialmultiomicsrevealtheroleofWntmodulator,Dkk2,inpalatogenesis.bioRxiv(2023).doi:10.1101/2023.05.16.541037
3.JanesickA,etal.Highresolutionmappingofthetumormicroenvironmentusingintegratedsingle-cell,spatialandinsituanalysis.NatCommun(2023).14:8353.doi:10.1038/s41467-023-43458-x